








Bài viết giới thiệu tác dụng của một số polysaccarides có thể sử dụng để kiểm soát dịch bệnh trên động vật thủy sản, bao gồm: Carrageenan, Sodium alginate, Ergosan, Laminaran, β-glucan, Chitosan, Fucoidan, Alginic acid.
Dịch bệnh là một trong những tác nhân chính đe dọa đến ngành nuôi trồng thủy sản. Theo truyền thống, cách để kiểm soát dịch bệnh thường là sử dụng kháng sinh hay các chất hóa học khử trùng, nhưng chúng không được khuyến khích dùng vì có sự xuất hiện của các chủng kháng bệnh cũng như việc tích lũy dư lượng thuốc trong môi trường và sinh vật khác. Mặc dù vaccine rất hiệu quả trong việc chống lại bệnh ở cá nhưng chúng khá đắt, tốn thời gian và gây stress cho cá. Trong bối cảnh này, chất đáp ứng miễn dịch có thành phần tự nhiên giúp cá tôm tăng sức đề kháng với các mầm bệnh bắt đầu được sử dụng rộng rãi trong nuôi trồng thủy sản. Sử dụng chất đáp ứng miễn dịch ngày càng được chú ý vì chúng ít độc hơn, thân thiện môi trường thiên nhiên, hoạt tính sinh học cao. Chúng đóng vai trò quan trọng đối với cá có vảy và các loài thủy sinh vật có vỏ.

Công thức cấu tạo chung của Polysaccharide.
Những năm gần đây, các nhà khoa học đã chú ý đến các tác dụng của polysaccharide (là phân tử carbohydrate cao phân tử gồm chuỗi dài của đơn vị monosaccharide liên kết với nhau bằng mối liên kết glycosidic) có nguồn gốc từ đại dương được gọi là Marine polysaccharide, như là một tác nhân điều trị hay sản xuất kháng sinh, chúng ít độc tố và có hoạt lực sinh học cao. Polysaccharide nói chung sẽ được phân tách dựa trên nguồn gốc riêng biệt của chúng (từ thực vật, động vật và vi khuẩn).
Ở cá, người ta đã chứng minh rằng một số chất được hấp thụ từ rong biển, chủ yếu là polysaccharide có thể tác động đến hoạt động của một số thành phần trong hệ thống miễn dịch và làm tăng khả năng miễn dịch của cơ thể với bất cứ mầm bệnh nào. Ở cá chép, nếu tiêm vào xoang bụng chất Carrageenan – một polysaccharide dồi dào có ở rong biển đỏ, sẽ làm tăng hoạt động thực bào và sức đề kháng chống lại sự nhiễm khuẩn. Ngoài ra, Sodium alginate cũng được biết đến là muối polysaccharide giúp đẩy nhanh sự di chuyển thể thực bào ở thượng thận cá chép đến khoang bụng và làm tăng khả năng thực bào khi nhiễm khuẩn V. anguillarum. Thêm vào đó, Ergosan – một polysaccharide chiết xuất từ tảo biển, chứa nhiều acid alginic sẽ làm tăng tỉ lệ bạch cầu hạt trung tính, mức độ thực bào, chất oxy hóa và sự biểu hiện của interleukins (thuộc nhóm cytokine, là chất trung gian điều hòa giữa các tế bào trong cơ thể) ở cá hồi cầu vồng. Những polysachharides khác như laminaran và β-glucan được hấp thu từ tảo nâu Laminaria hyperborea, tăng hoạt động của đại thực bào trên cá hồi.
Tương tự, Chitosan (β-(1, 4)-2-amino-2-deoxy-D-glucose) là một cation polyme thu được từ quá trình deacetyl hóa (quá trình đẩy nhóm acetyl ra khỏi hợp chất) của chitin. Chitosan polysaccharide có tác dụng thúc đẩy hoạt động miễn dịch ở cá và các loài động vật thủy sản có vỏ. Ví dụ ở tôm thẻ chân trắng, việc tiêm chitin hay chitosan có thể giúp tăngkhả năng sống sót khi nhiễm khuẩn V. alginolyticus nhờ thúc đẩytăng tế bào máu, chất oxy hóa và hoạt động thực bào. Một số báo cáo cho thấy, sự kích thích hoạt động miễn dịch của chitin hoặc chitosan thường có ở cá hồi cầu vòng, cá hôi vân, cá tráp đầu vàng. Một nghiên cứu khác của Gopalakannan và Arul so sánh giữa các chất chitin, chitosan and levamisole ở cá chép nhằm chống lại sự nhiễm khuẩn Aeromonas hydrophila trong ao, cho thấy rằng nhóm được cho ăn chitosan sẽ tăng cường hệ thống miễn dịch bẩm sinh và tỉ lệ sống sót ở cá chép. Ngoài ra, Niu cũng cho hay chitin and và dẫn xuất của mình (chitosan, chitosan oligosaccharides và N-acetyl-D-glucosamine) kích thích tăng trưởng, là chất chống oxi hóa và tình trạng chất oxy hóa trên tôm sú.
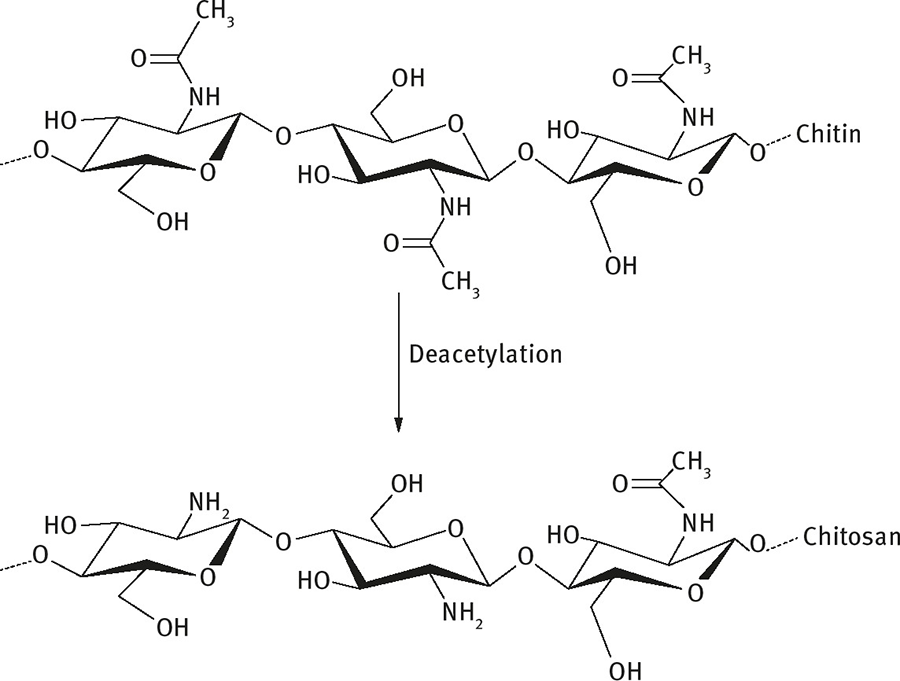
Quá trình deacetyl hóa Chitin để tạo ra Chitosan.
Fucoidan (sulfated polysaccharides) thường được tìm thấy trong tảo nâu và một số động vật không xương sống như hải sâm và nhím biển. Chúng chủ yếu gồm fucose và sulfate với lượng nhỏ galactose, xylose, mannose, và uronic acids.
Fucoidan có các tác dụng sinh học đa dạng như là thuôc chống đông máu, chống ung thư, điều hòa miễn dịch và chống viêm. Từ các hoạt động sinh học tiềm năng khác của fucoidan, Chotigeat đã tiến hành thí nghiệm về khả năng kháng virus đốm trắng của fucoidan thô chiết xuất từ Sargassum polycystum (rong mơ). Ngoài ra, khi cho tôm sú ăn fucoidan 200mg/kg trọng lượng thân trên một ngày thì tỉ lệ sống đạt 93%. Thêm vào đó, chúng còn ngăn ngừa sự tăng trưởng của các loài vi khuẩn gây hại như Vibrio harveyi, Staphylococcus aureus và Escherichia coli. Tương tự, Immaunel cho biết fucoidan từ rong mơ Sargassum wightii làm giảm tỉ lệ chết lên đến 68.06% và tăng cường các thông số miễn dịch như: THC (số lượng tế bào máu), hoạt động của enzyme prophenoloxidase, chất oxy hóa, enzyme superoxide dismutase (là một enzyme làm trung hòa gốc tự do) và hoạt động thực bào. Sivagnanavelmurugan cũng dùng fucoidan từ rong mơ Sargassum Wightii cho ấu trùng Artemia ăn (400mg/L) và dùng Artemia cho tôm sú ăn sẽ giảm tỉ lệ chết còn 61.6% và chống lại sự nhiễm bệnh đốm trắng. Ở thí nghiệm của Marudhupandi and Ajith Kumar, fucoidan chiết xuất từ Turbinaria cho thấy tiềm năng kháng khuẩn trên bệnh cá cảnh biển như Aeromonas hydrophila, Enterobacter sp., Pseudomonas aeruginosa, treptococcus sp., Escherichia coli, Vibrio parahaemolyticus, Vibrio alginolyticus, Vibrio cholerae, Yersinia enterocolitica and Proteus sp. Marlowe cũng tiến hành điều tra khả năng điều hòa miễn dịch của alginic và fucoidan, cả hai chất trên đều có nguồn gốc từ rong nâu. Gần đây Kitikiew cho hay fucoidan có khả năng kích thích miễn dịch bẩm sinh của tôm thẻ chân trắng và khả năng chống lại khuẩn V. alginolyticus.

Cấu tạo của Fucoidan.
Alginic acid là một polysaccharide anion nổi tiếng và phân bố chủ yếu ở thành tế bào của tảo nâu. Axit alginic là một chất đồng trùng hợp tuyến tính với các khối homopolymeric của (1-4) liên kết-D-mannuronate (M) và epime C-5 của nó dư lượng α-L-guluronate (G), tương ứng, liên kết cộng hóa trị với nhau trong các chuỗi hoặc khối khác nhau. Các đơn phân có thể xuất hiện trong các khối đồng nhất của dư lượng G liên tiếp (khối G), dư lượng M liên tiếp (khối M) hoặc dư lượng M và G xen kẽ (khối MG).
Chỉ một số hoạt động miễn dịch alginic acid được công bố. Ở cá, alginic acid làm tăng hoạt động của tế bào thực bào thượng thận và sự di chuyển của chúng từ vị trí tiêm bởi sự tăng sản xuất các yếu tố hóa học và độ nhạy cảm của chúng. Tiêm xoang bụng Ergosan (chứa 1% alginic acid) sẽ làm tăng tế bào bạch cầu trung tính, mức độ thực bào và hoạt động kích ứng oxy ở cá Hồi Vân cũng như sự biểu hiện của interleukins (IL-1b) và chemokines. Tuy nhiên, nó không có tác dụng đối với lysozyme và hoạt động chống lại protease khi quá khoảng thời gian 7 ngày. Alginic acid và Fucoidan có thể điều chỉnh phản ứng của tế bào đặc biệt là chất oxy hóa và leukocytes thượng thận ở cá Tuyết Đại Tây Dương. Như vậy, từ những cơ sở trên cho thấy polysaccharide có thể được sử dụng để phát triển thành những liệu pháp như đáp ứng miễn dịch hoặc thuốc kiểm soát bệnh thủy sản.
Theo Thangapandi Marudhupandi và Dhinakarasamy Inbakandan.

Vi khuẩn kháng kháng sinh bắt đầu gia tăng trong hệ thống nuôi tuần hoàn, vốn đang là kỹ thuật điển hình để giảm sự ảnh hưởng của kháng sinh và các gen kháng thuốc.
Kháng sinh được sử dụng rộng rãi trong nuôi trồng thủy sản vì chúng có vai trò thúc đẩy sự tăng trưởng và ức chế các bệnh do vi khuẩn gây ra. Khi diện tích nuôi trồng lớn, đi kèm với đó là việc lạm dụng kháng sinh ngày càng nghiêm trọng.
Sử dụng kháng sinh là nguyên nhân quan trọng dẫn đến ô nhiễm nguồn nước, xuất hiện các gen kháng kháng sinh (gen kháng thuốc) làm cho việc kiểm soát mầm bệnh càng khó khăn hơn. Hơn nửa vi khuẩn kháng đa kháng sinh cũng xuất hiện. Do đó, các gen kháng thuốc được các nhà nghiên cứu rất chú ý.
Những năm gần đây, ngành nuôi trồng thủy sản đã mở rộng quy mô và diện tích cũng như ngày càng tiến bộ trong các nghiên cứu chuyên sâu. Hai hệ thống nuôi điển hình là nuôi thâm canh tuần hoàn nước và nuôi tự nhiên theo hình thức quảng canh. Nước thải với hệ thống tuần hoàn sẽ được tái sử dụng thông qua hệ thống xử lý. Còn trong hệ thống nuôi quảng canh, nước xử lý đơn giản hơn và thải trực tiếp ra môi trường.
Hệ thống nuôi tuần hoàn đã trở thành một mô hình nuôi điển hình phổ biến hiện nay. Với lợi thế sử dụng ít nước, kiểm soát các điều kiện nuôi chặt chẽ, hệ thống nuôi tuần hoàn ven biển đã được đánh giá rất cao. Nhờ lợi thế nước chỉ tuần hoàn trong hệ thống mà không xả ra bên ngoài hoặc xả ra rất ít nên các hệ thống nuôi tuần hoàn được coi là phương pháp quan trọng để ngăn chặn sự ảnh hưởng của kháng sinh và các gen kháng thuốc. Vì kháng sinh được sử dụng rộng rãi để phòng ngừa dịch bệnh và sử dụng như chất phụ gia thức ăn để thúc đẩy tăng trưởng cho vật nuôi.
Một loạt gen kháng thuốc đã được phát hiện trong nhiều hệ thống nuôi khác nhau và cũng không ngoại trừ hệ thống tuần hoàn nước. Liệu rằng công nghệ xử lý nước trong hệ thống này có làm giảm sự xuất hiện của gen kháng thuốc hay không và các gen này có gây mối đe dọa lớn cho môi trường không?
Để giúp bù đắp một số kiến thức về gen kháng thuốc, nghiên cứu này được thực hiện để điều tra sự phân bố của gen kháng thuốc trong một hệ thống nuôi thủy sản ven biển. Phương pháp PCR được sử dụng để định lượng, phân tích mức độ lan truyền cũng như cung cấp một số lý thuyết hỗ trợ đánh giá việc ảnh hưởng của môi trường đến hệ thống nuôi và phát triển được công nghệ điều trị gen kháng thuốc.
Các mẫu được thu thập từ một hệ thống nuôi trồng thủy sản tại thành phố Yên Đài, nơi chiếm 1/6 sản lượng hệ thống nuôi thủy sản ven biển ở Trung Quốc. Đây là các mẫu nước nuôi cá hồi Đại Tây Dương, nuôi tuần hoàn 90%, khử trùng bằng tia UV để loại bỏ một phần vi khuẩn trước khi cho vào ao. Các mẫu sau đó thu thập từ hệ thống tuần hoàn được đánh dấu từ R1 đến R7, R1 đến R6 là những mẫu nước nuôi, mẫu chiết tách protein và mẫu nước trong bộ lọc sinh học được chọn lọc, R7 là mẫu phân và thức ăn thừa được tách chiết protein.
Nghiên cứu được thực hiện theo các bước: Ly trích DNA với nồng độ tinh khiết cao, sau đó xét nghiệm PCR để phát hiện gen kháng thuốc. Tiếp theo chuẩn bị thêm 30 gen kháng thuốc bao gồm 3 gen kháng sulfonamid, 18 tetracycline, 4 quinolone và 5 gen kháng macrolide. Sử dụng phương pháp PCR và real time PCR để định lượng gen kháng thuốc. Sau đó giải trình tự gen 16S rRNA của vi khuẩn từ các mẫu DNA chiết xuất và khuếch đại chúng lên nhiều lần. Các mẫu kháng sinh được phân tích bằng phương pháp sắc ký lỏng sau đó tách chiết, phân tích và định lượng. Cuối cùng là phân tích thống kê để xác định mối quan hệ giữa vi khuẩn, kháng sinh và các gen kháng thuốc.
Trong số 30 gen kháng thuốc thử nghiệm thì có 10 gen được phát hiện có hàm lượng cao trong tất cả các mẫu thủy sản. Ở các khu vực nuôi có nhiệt độ khác nhau thì các gen kháng thuốc xuất hiện với tần xuất khác nhau. Các gen kháng sulfonamid là phong phú nhất, có trong tất cả các mẫu, đồng thời phát hiện trong các mẫu trầm tích đáy sông. Kế tiếp là quinolone cũng phát hiện với lượng lớn trong tất cả các mẫu.
Gen Int1 đóng vai trò quan trọng trong sự lan truyền gen kháng thuốc theo chiều ngang giữa các vi khuẩn, nó như các vector truyền. Int1 được tìm thấy rất nhiều trong các trại nuôi. Điều đó cho thấy rằng khả năng lan truyền của các gen kháng thuốc trong trại nuôi là rất lớn.
Nồng độ kháng sinh quinolone, tetracycline và marcrolide trong nước thử nghiệm tương đối cao, chứng tỏ là chúng đã bị kháng lại trong quá trình xử lý nước. Các kháng sinh có mối tương quan với nhau, tuy nhiên không tìm thấy sự tương quan rõ ràng giữa kháng sinh và các gen kháng kháng sinh tương ứng. Nên sự xuất hiện của chúng được suy ra bởi nhiều yếu tố, không chỉ do việc lạm dụng kháng sinh. Sự xuất hiện này cũng được chứng minh là do biến động của một vài yếu tố trong môi trường như P, NH3, NO2, tổng carbon. Theo phân tích cho thấy sự tăng cường tích lũy gen kháng thuốc có thể do sự gia tăng các yếu tố trên trong nước.
Mẫu R7 và nước trong bộ lọc sinh học là các mẫu có hàm lượng gen kháng thuốc nhiều nhất. Do đó, mùn bã hữu cơ đáy ao là nơi dự trữ lớn của nguồn gen này. Và nước trong bộ lọc sinh học là nơi sản sinh quan trọng nhất của chúng. Kiểm tra các mẫu còn lại cho thấy nước nuôi và mẫu tách chiết protein không phải là nơi tăng hàm lượng chính của các gen kháng thuốc. Một số báo cáo trước đây cho thấy rằng việc khử trùng nước bằng Clo và UV sẽ loại bỏ được gen kháng thuốc và các vi khuẩn.
Gen Int1 trong mẫu phân và thức ăn thừa là phong phú nhất. Do đó, sự lan truyền là rất dễ dàng. Các gen này ở nước tầng đáy sẽ cao hơn nước tầng giữa và tầng mặt. Các hệ thống nuôi thương phẩm là nơi dễ sinh ra các gen này. Ngoài ra cũng phát hiện các gen Int1 không sinh ra được trong quá trình ương giống của cá hồi.
Sử dụng bừa bãi thuốc kháng sinh là nguyên nhân làm xuất hiện các chủng vi khuẩn kháng thuốc, tuy nhiên cần hiểu đúng là kháng sinh và gen kháng thuốc không có nhiều mối tương quan, mà vi khuẩn mới chính là nguyên nhân sinh ra gen kháng thuốc. Vì vậy, dù không sử dụng kháng sinh, nhưng trong hệ thống nuôi tuần hoàn vẫn xuất hiện vi khuẩn kháng thuốc. Nghiên cứu cho thấy, khi nuôi tuần hoàn vi khuẩn kháng thuốc sẽ tích lũy một cách đáng kể trong phân và thức ăn ở lớp mùn bã hữu cơ đáy ao. Bên cạnh đó, việc giảm khử trùng bằng tia UV khiến các bộ lọc nước sinh học trở thành nơi sinh ra nhiều gen kháng thuốc nhất.
Nghiên cứu mang lại cái nhìn sâu hơn về vấn đề kháng thuốc trong nuôi thủy sản, từ đó giúp cải thiện các phương thức canh tác hiện tại cũng như phát triển mô hình nuôi mới trong tương lai.
Theo Jian-Hua Wang và cộng sự.
Trong môi trường đặc trưng, các ngoại sinh vật này bám trên vỏ tôm với lượng lớn gây ra các bệnh đặc trung trên tôm nuôi như: tôm đóng rong nhớt, tôm đen mang. So với lớp chất nhày của các loài khác thì lớp chitin trên vỏ giáp xác rất thích hợp cho việc bám và phát triển của ngoại sinh vật.
1. Ảnh hưởng của ngoại sinh vật bám trên tôm
Các ngoại sinh vật kí sinh trên tôm thường xuất hiện nhiều trong ao nuôi mật độ cao hoặc nước dơ, nhiều chất hữu cơ lơ lững. Chúng ăn vi khuẩn, tảo đơn bào và protozoa nhỏ hơn.
Hầu hết sinh vật kí sinh trên mang hoặc bề mặt là những sinh vật sống tự do, không thực kí sinh, chúng xem tôm như giá thể.
Ngoại sinh vật bám không gây hại trực tiếp cho tôm. Chúng gây ra các tác hại gián tiếp do:
Tuy nhiên, vài loài ngoại sinh vật bám có khả năng tạo ra ngoại độc tố gây tổn thương tế bào vật chủ.
2. Tác nhân
Vi khuẩn: các vi khuẩn dạng sợi, gram âm như Leucothrix mucor, Leucothrix spp. Vi khuẩn dạng sợi nhỏ và chuỗi như Flavobacterium sp., Cytophaga sp., Flexibacter sp., Vibrio sp., Spirochetets,…
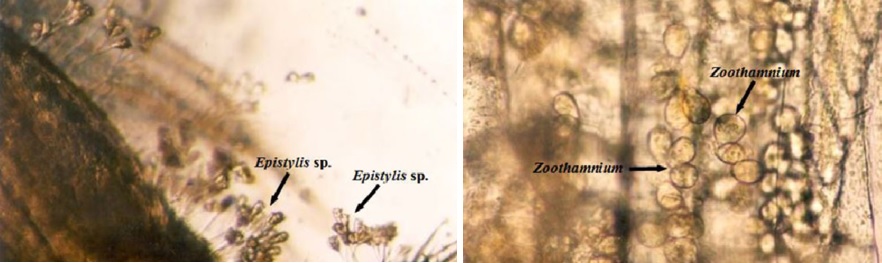
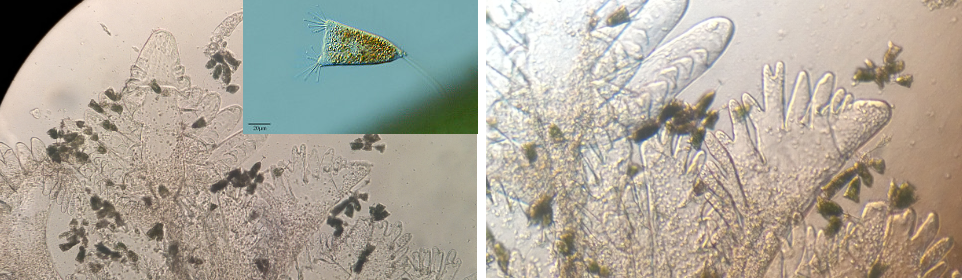
Protozoa: các protozoa có vành lông rung như Zoothanium sp., Epistilis sp., Vorticella sp. Apostome như Ascophrys spp. Loricate ciliates: Lagenophrys spp. Suctorians: Acineta spp., Ephelota sp., Flagellates: Bodo-like flagellates và Chrysidella sp.
Các loài protozoa khi gặp điều kiện sống không thuận lợi có thể đứt cuống, tìm nơi kí sinh mới.
Tảo: tảo silic lông chim như Nitzchia spp, Amphiprora spp và Navicula spp; tảo lục; tảo mắt; tảo lam như Spirulina subsala, Lyngbya, Schizothrix spp.
Ngoài các yếu tố sinh vật còn các yếu tố vô sinh như muối kim loại trong nước kết tủa lên vỏ tôm nuôi.
3. Chuẩn đoán
Dấu hiệu bệnh:
Màu sắc cơ thể bất thường: mang và phụ bộ chuyển sang màu nâu hoặc đen do cặn đáy, đất, các chất ngoại lai “bị bắt” bởi các ngoại sinh vật sống bám hoặc chuyển sang xanh hay xanh nâu do tảo.
Thường xuất hiện kèm các dấu hiệu bệnh gây ra do nhiễm khuẩn.

Mang chuyển màu do sợi khuẩn bám
Mang chuyển màu do tảo bám

Zoothamnium bám dày đặc trên vỏ tôm sú làm tôm chuyển màu đen và nhớt
Tôm lột xác và chết với vỏ sạch và mềm: tôm ăn và sống bình thường tới khi lột xác, vào thời điểm lột xác – thường vào giữa khuya tới sáng, tôm lột xác khó khăn trở nên rất yếu và dễ chết trong điều kiện oxy hòa tan thấp (dưới 3ppm).
Soi mẫu tươi dưới kính hiển vi
Chuẩn bị mẫu: cắt lấy mang, phụ bộ và chóp đuôi tôm soi dưới kính hiển vi để kiểm tra sự hiện diện của ngoại sinh vật bám.

Chuẩn bị mẫu và soi dưới kính hiển vi
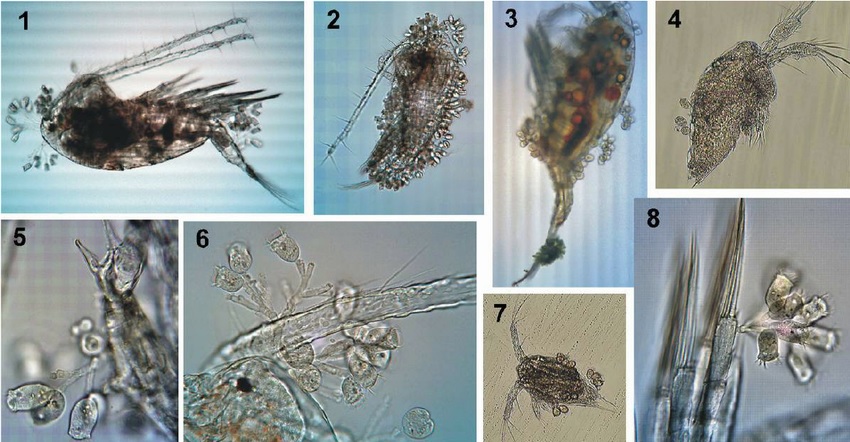
Nhận dạng một số loài ngoại sinh vật bám thường gặp trong ao tôm dưới kính hiển vi:

Zoothamnium và Carchesium
Do cơ co rút của Zoothamnium dính nhau nên các tế bào sẽ co rút cùng một lượt. Tế bào Carchesium co rút đơn lẽ.
Kiểu co rút cơ ở Zoothamnium
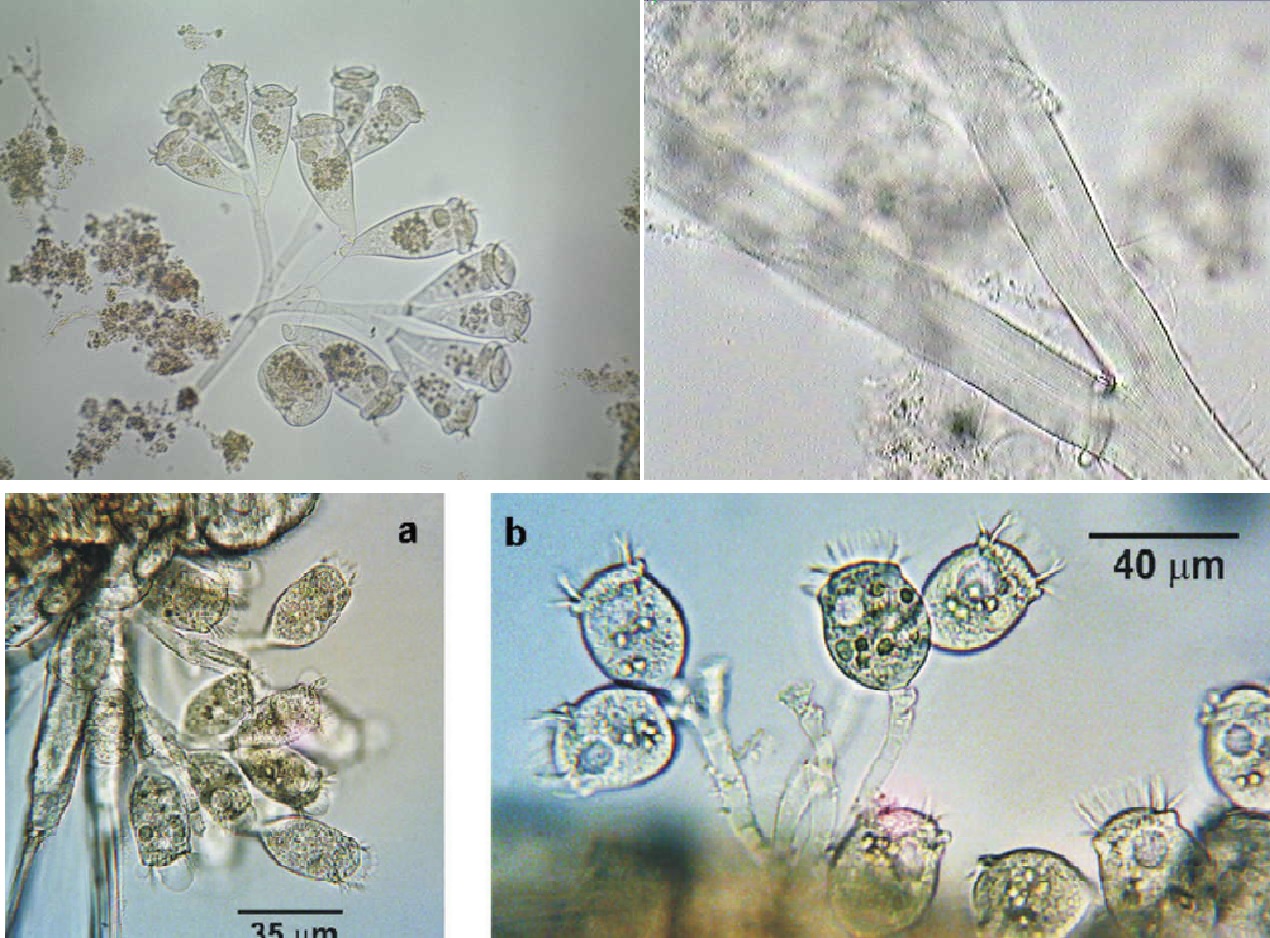
Epistylis
Epistylis bám trên copepoda
Epistylis và Zoothamnium trên mang tôm thẻ chân trắng
Acineta bám trên mang tôm
Thông thường sự bám này không làm tổn hại các tế bào biểu mô chổ bám nhưng cho phép các chất cặn và tảo bám vào mang nên gây ngạt thở cho tôm.
Dưới kính hiển vi 10 – 40X, sợi khuẩn có dạng sợi dài ngắn nhiều kích thước, trong suốt, một đầu bám vào vỏ tôm, một đầu di động uốn lượn trong nước.
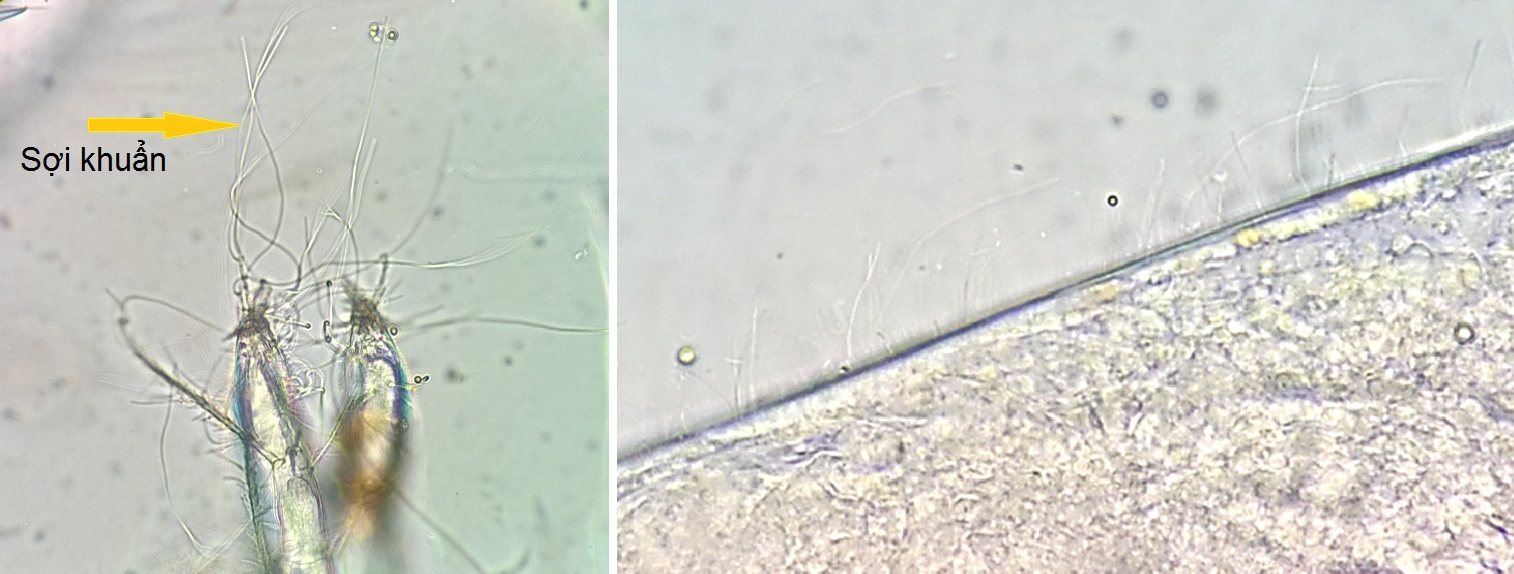
Sợi khuẩn bám trên chân bò và vỏ của tôm thẻ giống

Tảo bám trên copepoda

Tảo lam bám trên mang tôm sú
Kiểm tra ngoại sinh vật bám:
Lấy mẫu tôm bệnh: chọn từ 3 – 10 cá thể bệnh vì giúp biết được nguyên nhân gây bệnh từ đó xác định loại thuốc hợp lý để cứu những con còn lại.
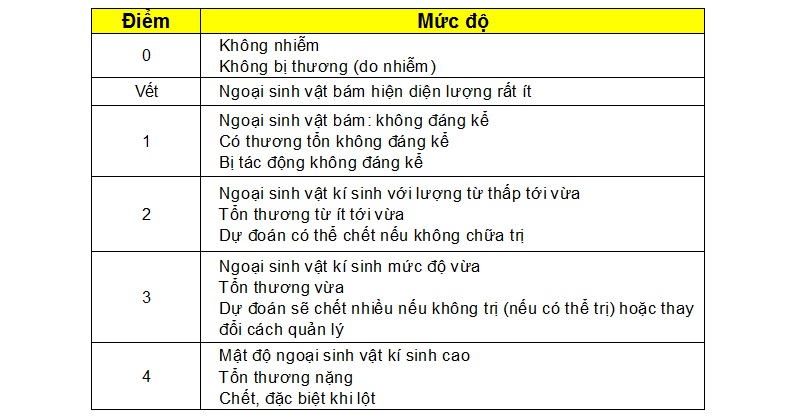
Kiểm tra mang và phụ bộ: soi tươi ở độ phóng đại 10 – 40X, so sánh mức độ cảm nhiễm theo bảng:
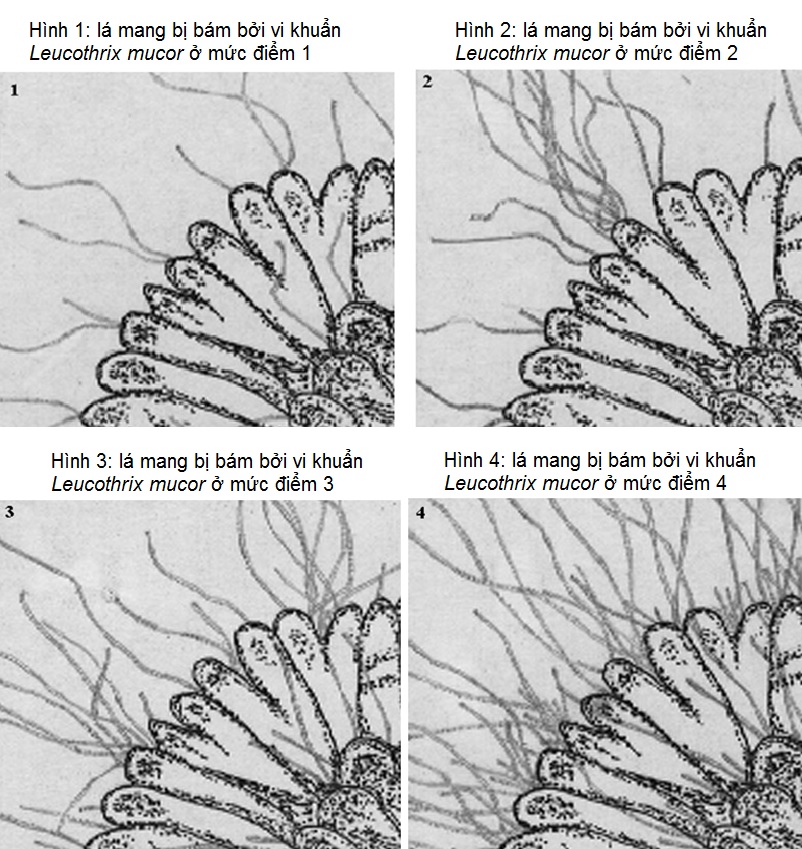
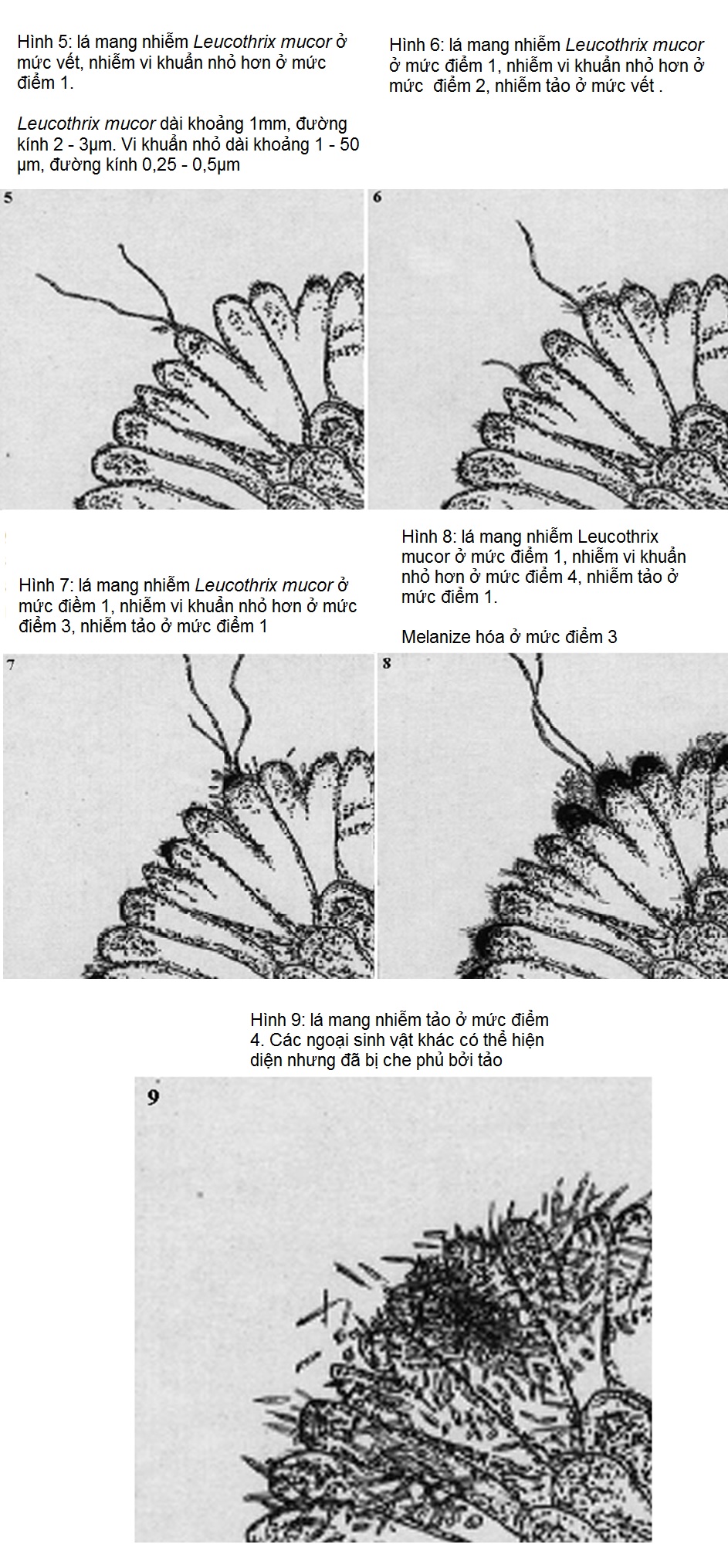
6. Xử lý
Khi mật độ ngoại sinh vật bám quá nhiều hoặc sự bám gây ra các tổn thương trên mô làm tôm có xu hướng tăng lột xác tự làm sạch. Khi tôm lột xác, ngoại sinh vật bám có thể trở lại dạng sống tự do trong nước và tiếp tục tái bám vào tôm vừa lột xong.
Thông thường, khi tôm bị các sinh vật bám chứng tỏ tình trạng ao nuôi xấu, nước dơ, nhiều khí độc và chất hữu cơ vậy nên trong xử lý cần coi trọng cải tạo chất lượng nước thay vì kích lột cho tôm.
Lưu ý rằng lột xác là quá trình tốn hao năng lượng, suy giảm nguồn sống và dễ bị tấn công bởi kẻ thù. Tôm đen mang thường kiệt sức rất nhanh và không có sức chống chịu áp lực môi trường như tôm khỏe sau khi lột xác. Nếu tôm bị kích thích lột xác trong điều kiện nước xấu sẽ rất yếu và dễ nhiễm các bệnh khác.
Có thể xử lý tình trạng tôm nhiễm ngoại ký sinh như sau:
Tốt nhất là nên kiểm tra tôm thường xuyên và điều trị ngay từ giai đoạn 1 (vài con ngoại kí sinh/tôm).
| Nguồn: Theo Tổng hợp – nghetomtep.com |

Bài viết phân tích về các trường hợp xãy ra bệnh hoại tử cơ trên tôm nuôi.
1. Nguyên nhân:
Do Virus:
Gồm 2 chủng virus là IMNV thuộc họ Totiviridae (Infectious myonecrosis virus) gây đục cơ trên tôm thẻ gặp ở Brazil và chủng PvNV thuộc họ nodavirus (Penaeus vannamei nodavirus) gặp ở Belize.
Bệnh do virus gây ra sẽ lây truyền theo chiều ngang (tôm khỏe sang tôm bệnh thông quan môi trường nước hoặc tôm khỏe ăn tôm bệnh) và dọc (từ tôm bố mẹ sang tôm giống).
Khi môi trường biến động, IMNV có thể gây chết từ 40 – 70% tôm thẻ nhiễm bệnh trong khi PvNV không gây chết cho tôm. Bệnh do IMNV thành dịch chủ yếu xảy ra trên tôm thẻ chân trắng P. vannamei (trong tất cả độ mặn). Có gây nhiễm thí nghiệm trên tôm xanh P. stylirostris và tôm sú P. monodon nhưng bệnh không gây chết.
Các dấu hiệu bệnh bao gồm:
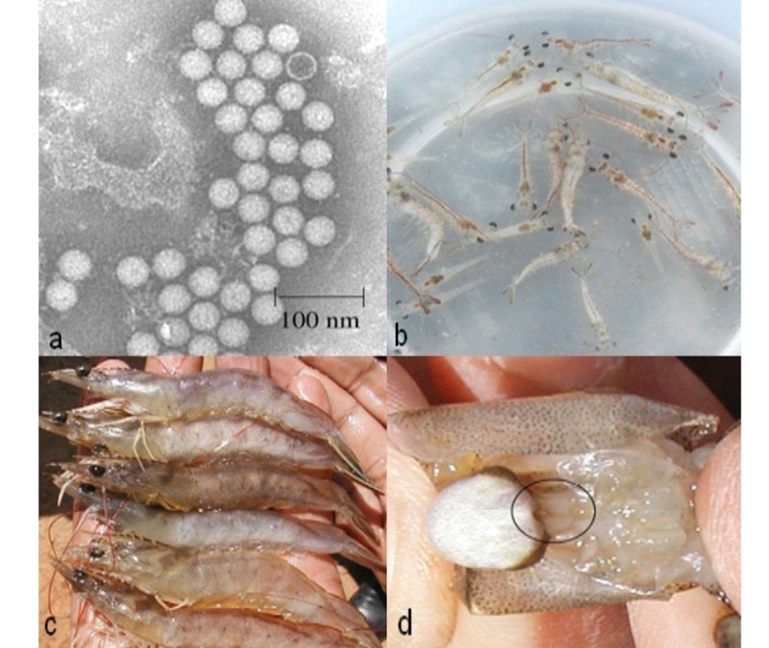
Bệnh hoại tử cơ do virus (IMNV). (a) Hình chụp dưới kính hiển vi điện tử, IMNV nhiễm tự nhiên trên tôm thẻ chân trắng ở Brazil; (b) (c) dấu hiệu bệnh hoại tử cơ trên tôm thẻ chân trắng do virus; (d) kích thước của cơ quan bạch huyết của tôm nhiễm IMNV tăng gấp 2-4 lần so với kích thước thông thường (đánh dấu trong vòng tròn). Nguồn: Lightner, 2011

Tôm thẻ nuôi có các dấu hiệu hoại tử cơ vận động như xuất hiện các vùng cơ bị đục, biến màu (mũi tên. A – Mô bệnh học tôm bệnh cho thấy các vùng cơ hoại tử (mũi tên rộng) và nhiễm trùng máu (mũi tên hẹp). B – mô cơ tôm khỏe

Tôm thẻ có thể có các vùng hoại tử cơ (mũi tên) nhưng không gây chết nếu môi trường nuôi ổn định
Do các nhân tố không lan truyền
Bao gồm căng thẳng do thay đổi các yếu tố môi trường (như sự thay đổi đột ngột của nhiệt độ, độ mặn và oxy hòa tan). Khi tôm bệnh được đặt nơi sục khí tốt phần cơ trắng sẽ tan đi trong vòng 24 giờ và tôm hoạt động trở lại.
Triệu chứng hoại tử cơ do các nhân tố không lan truyền sẽ không gây viêm mô cơ.
Do vi khuẩn
Bệnh thường do nhiễm vi khuẩn Vibiro harveyi, vibrio parahaemolyticus.
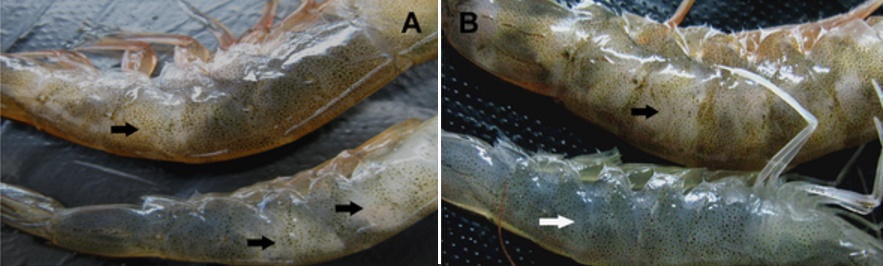
Hình bên trái là tôm thẻ tự nhiên có biểu hiện bệnh đục cơ, cơ đuôi tôm có các điểm hoặc vùng rộng màu trắng đục (mũi tên đen), thân và phụ bộ xuất hiện màu đỏ. Hình bên phải, tôm bên trên là gây nhiễm thực nghiệm với vi khuẩn V. harveyi cũng xuất hiện các điểm hoặc vùng rộng màu trắng đục (mũi tên đen), tôm bên dưới khỏe, cơ trong suốt (mũi tên màu trắng).
Tôm nhiễm Vibrio thường có biểu hiện ban đầu rất bình thường nhưng sau khi sốc (có thể do chuyển tôm từ nơi này đến nơi khác hoặc do sốc nước) sẽ xuất hiện các vùng cơ trắng đục ở phần bụng, có thể kèm theo đỏ thân và phụ bộ. Vùng cơ trắng có thể chuyển thành đỏ sau đó do hoại tử. Nếu tỉ lệ nhiễm bệnh trong đàn tôm cao, tôm sẽ chết rất nhiều vài ngày sau khi xuất hiện dấu hiệu bệnh.
Giống như các trường hợp gây nên hoại tử cơ khác, hoại tử cơ do vi khuẩn cũng có liên hệ mật thiết với biến động môi trường và mật độ nuôi. Các nghiên cứu đã chỉ ra rằng mật độ tế bào V. harveyi có thể tăng nhanh do sự thay đổi đột ngột của nhiệt độ, độ mặn, hàm lượng dinh dưỡng và mật độ thả. Khi mật số V. harveyi tăng lên, tôm dễ bệnh và chết.

Một ao tôm ấu niên xuất hiện tình trạng đục cơ, gan nhạt màu, teo nhỏ khi mới 15 ngày tuổi với các dấu hiệu đi kèm như: hạt sắc tố nở to, tôm bơi tắp mé, đục cơ 3 đốt giữa lưng, bong tróc ống gan tụy và hoại tử mang
2. Tác hại của bệnh hoại tử cơ:
Có thể gây chết 40 – 70% tôm trong suốt thời gian nuôi, nhất là vể cuối vụ (nếu tôm nhiễm IMNV). Các nguyên nhân gây bệnh còn lại cũng có thể gây chết rải rác.
Tôm không chết thì khả năng chống chịu thay đổi môi trường kém, miễn dịch yếu dễ chết khi điều kiện môi trường thay đổi hoặc nhiễm bệnh thứ cấp.
Tôm thu hoạch yếu, không thể vận chuyển xa.
3. Chuẩn đoán bệnh
Dựa trên các dấu hiệu bệnh lý đặc trưng. Do có nhiều nguyên gây ra hiện tượng hoại tử cơ nên để nhận biết tác nhân gây bệnh thì các phần mô từ cơ hoại tử phải được kiểm tra bằng kính hiển vi, làm mô bệnh học, cấy khuẩn và chạy PCR.
4. Phòng trị bệnh
Nhìn chung tình trạng đục cơ rất thường hay xuất hiện trong ao nuôi và khó xác định được nguyên nhân cụ thể.
Trừ khi đục cơ xuất hiện ở tôm giống và tôm ấu niên (chiều dài 2 – 3 cm) thì không thể điều trị, phải hủy bỏ, còn ở các giai đoạn tôm lớn hơn có thể cải thiện bằng cách giảm mật độ nuôi, tăng cường sực khí đảm bảo oxy hòa tan trong nước cao, hạn chế khí độc và bùng phát tảo trong ao. Điều chỉnh lượng thức ăn cũng rất quan trong trong phòng trị bệnh hoại tử cơ và lượng chất hữu cơ trong nước liên quan mật thiết với hàm lượng các khí độc cũng như mật độ vi khuẩn.
Nên sử dụng các sản phẩm tăng cường sức đề kháng cho tôm trong suốt quá trình nuôi và các chế phẩm sinh học xử lý nước, giảm căng thẳng, cạnh tranh hại khuẩn.
nguồn thuysan247.com
| Khắc tinh của virus gây bệnh đốm trắng ở tôm |
| Bệnh đốm trắng do virus là một trong các bệnh gây nên hiện tượng tôm nuôi chết hàng loạt trong các vùng nuôi tôm tại các địa phương ven biển ở nước ta từ nhiều năm qua. Để giải quyết bệnh đốm trắng cho tôm, mới đây, các nhà khoa học thuộc Trường ĐH Khoa học Tự nhiên, ĐHQGHN, đã chế tạo thành công chế phẩm Probiotic đề phòng virus gây bệnh đốm trắng ở tôm. |
| Bài toán nan giải
Việt Nam có bờ biển chạy dài từ Bắc xuống Nam, có hàng nghìn hòn đảo lớn nhỏ tạo nên một lợi thế lớn cho hoạt động đánh bắt và nuôi trồng thủy sản. Thực tế thì ngành thủy sản đã trở thành ngành kinh tế mũi nhọn của Việt Nam, tuy nhiên, để phát triển bền vững cần có sự vào cuộc của các nhà khoa học với những đề tài mang tính ứng dụng cao. Chưa kiểm soát tốt dịch bệnh là một hạn chế lớn của ngành thủy sản Việt Nam hiện nay. Có thời điểm, ngành thủy sản điêu đứng trước những dịch bệnh xảy ra trên tôm, cá vì bị nhiễm nấm, virut do thời tiết nóng, độ ẩm cao. Do thời tiết bất thường, vùng nuôi ô nhiễm là nguyên nhân chính gây nên bệnh đốm trắng trên tôm. Khi ao nuôi xuất hiện dịch bệnh này người nuôi cần có phương án xử lý thích hợp để tiêu diệt mầm bệnh, tránh lây lan. Theo các nhà khoa học, tác nhân gây ra bệnh đốm trắng trên tôm do virus hoặc vi khuẩn gây ra, bệnh thường có tốc độ lây lan rất nhanh và mức độ gây hại rất lớn. Thời gian gây bệnh thường từ tháng nuôi thứ hai trở đi, khi mà lượng chất thải nuôi tôm bắt đầu xuất hiện nhiều, môi trường nước ao bị ô nhiễm, gây stress cho tôm; mầm bệnh có thể đã ủ trong tôm hoặc xâm nhập từ bên ngoài vào qua nguồn nước hoặc các loại ký chủ trung gian (cua, còng, cáy, chim…). Khi gặp thời thiết thay đổi sẽ tạo điều kiện cho các loại virus, vi khuẩn bùng phát gây ra dịch bệnh cho tôm. Bệnh đốm trắng do virus là một trong các bệnh gây nên hiện tượng tôm nuôi chết hàng loạt trong các vùng nuôi tôm tại các địa phương ven biển ở nước ta từ nhiều năm qua. Riêng năm 2014, theo số liệu của Cục Thú y, Bộ Nông nghiệp và Phát triển nông thôn, bệnh đốm trắng đã xảy ra tại 250 xã, 68 huyện thuộc 22 tỉnh, thành phố trong cả nước, trải dọc theo chiều dài đất nước từ Quảng Ninh đến Cà Mau. So với năm trước, tuy số các địa phương để xảy ra bệnh đốm trắng giảm nhưng diện tích nuôi tôm bị bệnh lại tăng gần gấp đôi, lên tới hơn 22.600 ha, chiếm 3,33% tổng diện tích nuôi tôm của cả nước – trong đó có hơn 13.300 ha nuôi thâm canh và bán thâm canh, cùng với hơn 9.200 ha nuôi quảng canh và quảng canh cải tiến. Qua theo dõi, nhận thấy bệnh đốm trắng xảy ra trong năm qua ở cả 2 loài tôm nuôi chính là tôm chân trắng và tôm sú, với độ tuổi từ 10 đến 110 ngày sau khi thả giống. Diện tích nuôi tôm sú bị bệnh này nhiều hơn, chiếm khoảng 60% số diện tích nuôi tôm bị bệnh đốm trắng. Giải pháp hữu hiệu Để giải quyết bài toán bệnh bệnh đốm trắng cho tôm, mới đây, các nhà khoa học thuộc Trường ĐH Khoa học Tự nhiên, ĐHQGHN, đã chế tạo thành công chế phẩm Probiotic đề phòng virut gây bệnh đốm trắng ở tôm. Thông qua việc thực hiện đề tài Nghiên cứu sản xuất chế phẩm probiotic dạng bào tử Bacillus tái tổ hợp để phòng chống virus gây bệnh đốm trắng ở tôm, mã số KC04.09/11-15, PGS.TS Phan Tuấn Nghĩa và các cộng sự Trường Đại học Khoa học Tự nhiên đã nghiên cứu sản xuất thành công dưới dạng vaccine và thử nghiệm ở quy mô pilot chế phẩm probiotic bào tử Bacillus subtilis biểu hiện kháng nguyên của virus gây bệnh đốm trắng ở tôm (tôm sú và tôm thẻ chân trắng). Cụ thể là đã sản xuất được ở quy mô pilot 20 kg nồng độ lớn hơn hoặc tương đương 5×109/g probiotic bào tử Bacillus subtilis biểu hiện VP28 dạng CotB-VP28 và 10kg chế phẩm probiotic bào tử Bacillus subtilis biểu hiện VP28 có khả năng kích thích đáp ứng miễn dịch và bảo vệ 70% tôm không bị nhiễm bệnh đốm trắng… “Phòng trừ bệnh cho tôm bằng phương pháp sử dụng công nghệ gen nhằm tạo ra vắc xin thế hệ mới mang kháng nguyên của tác nhân gây bệnh rồi sau đó đưa vào tôm. Điều này cho phép kích thích hệ thống miễn dịch của tôm, nhờ vậy tôm sẽ có khả năng chống lại các tác nhân gây bệnh”, PGS. TS Phan Tuấn Nghĩa cho biết. Nghiên cứu của các nhà khoa học đã thu được kết quả ban đầu khá tốt. Khi có nguy cơ lây nhiễm virus đốm trắng ở trong đầm nuôi thì tôm có khả năng phòng bệnh cao. Kết quả thu được đối với tôm thẻ chân trắng đạt trên 75%, còn tôm sú là trên 70%. Nhóm nghiên cứu cũng đã phối hợp với viện nuôi trồng thủy sản 1 và 2 thuộc Trường ĐH Cần Thơ để thử nghiệm cho thấy kết quả đạt được trên tôm sú và tôm thẻchân trắng rất khả quan. Quy trình nuôi này cũng có tác dụng ban đầu trên thực tế. Việc sử dụng chế phẩm sinh học nhằm hạn chế tối đa khả năng sử dụng kháng sinh trong việc phòng và trị bệnh thủy sản là khuynh hướng đúng nhằm tránh khả năng tạo ra các dòng vi khuẩn kháng thuốc ảnh hưởng đến sức khỏe vật nuôi và con người. |
| Đức Minh – VNU Media |
Công nghệ Shrimp MultiPath được phát triển cho ngành tôm nuôi tại Australia đang phải đối mặt tổn thất lớn từ dịch bệnh suốt hơn 3 năm qua. Shrimp MultiPath có thể phát hiện chính xác 13 loại dịch bệnh trên tôm, trong đó có cả dịch bệnh đốm trắng từng khiến ngành tôm Australia bị thiệt hại nặng nề vào năm 2016 và bệnh hoại tử vỏ và cơ quan tạo máu (IHHNV).
Theo CSIRO, Shrimp MultiPath đã được sử dụng thí điểm tại một số trại nuôi tôm như một công cụ quản lý dịch bệnh IHHNV. Kết quả cho thấy, Shrimp MultiPath giúp trại nuôi tăng sản lượng tới 3,7 tấn/ha, tương đương 67.000 USD. Điều này đồng nghĩa, một trại nuôi tôm rộng 50 ha có thể tăng doanh thu tới hơn 3 triệu USD/vụ nếu sử dụng công nghệ chẩn đoán bệnh này.

Tổng diện tích ao nuôi thuộc các trang trại tôm tập trung dọc phía Bắc New South Wales và Queensland lên tới 750 ha. Do đó, nếu có thể tăng sản lượng 3,7 tấn/ha thì năng suất nuôi tôm toàn vùng này có thể tăng thêm 50%. Giám đốc CSIRO, Tiến sĩ Larry Marshall chia sẻ: Genics – đơn vị chịu trách nhiệm kinh doanh cho CSIRO đã đưa các kết quả nghiên mang tính đột phá của Cơ quan khoa học quốc gia Australia vào ứng dụng thực tiễn trên thị trường. Các xét nghiệm nhanh của Genics giúp người nuôi tôm đưa ra quyết định quản lý trại nuôi tốt hơn, giảm thiểu tổn thất do tôm chết, bệnh; tăng sản lượng và giảm phụ thuộc vào nguồn tôm nhập khẩu. Từ đó mang lại các sản phẩm tôm nuôi chất lượng cao tại nội địa tới người tiêu dùng tại Australia.
Shrimp MultiPath phát hiện được bệnh đốm trắng và nhiều mầm bệnh nước ngoài chưa từng xuất hiện tại Australia. Công nghệ này cũng được các cơ quan an toàn sinh học sử dụng như một hệ thống phát hiện sớm nhằm ngăn chặn lây lan dịch bệnh có thể gây tổn hại ngành tôm trong tương lai.