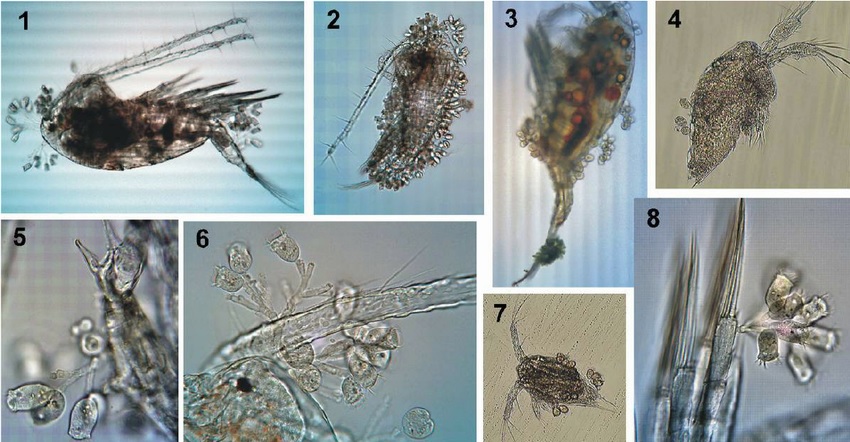
Nghiên cứu men vi sinh mới phù hợp cho nuôi thủy sản mặn lợ

Các nhà khoa học đã nghiên cứu phân lập bọt biển để tìm ra chủng vi sinh phù hợp với nuôi trồng thủy sản nước mặn – lợ, nhằm khắc phục hạn chế của men vi sinh có nguồn gốc trên cạn khi dùng ở độ mặn và nhiệt độ cao.
Một số loài vi khuẩn làm tăng tỷ lệ tử vong ở tôm và gây thiệt hại kinh tế lớn. Nghiêm trọng nhất là Hội chứng hoại tử gan tụy cấp (AHPND) do vi khuẩn Vibrio (V. parahaemolyticus) gây ra tỷ lệ chết đáng kể, có thể lên đến 100% trên tôm nuôi bị nhiễm bệnh tại nhiều quốc gia. Trong đó hiệu quả kiểm soát các dòng Vibrio spp. của kháng sinh và chất khử trùng khá hạn chế. Dẫn đến việc sử dụng men vi sinh làm công cụ kiểm soát dịch bệnh ngày càng được quan tâm và phổ biến.
Hiện tại, có rất nhiều men vi sinh thương mại, chủ yếu dựa trên các chủng vi khuẩn Lactobacillus và Bacillus. Thông qua việc thay đổi hệ vi sinh đường ruột trong tôm bằng cách tiết ra các chất kháng khuẩn, nhằm cạnh tranh chống lại mầm bệnh, ngăn chặn sự bám dính của chúng vào biểu mô ruột, cạnh tranh các chất dinh dưỡng cần thiết và chống độc.
Ở môi trường biển, dòng Vibrio spp. thuận lợi phát triển trong độ mặn và nhiệt độ cao, trong khi hầu hết các chủng men vi sinh thương mại hiện nay lại có nguồn gốc trên cạn, vì thế hiệu quả của chúng bị hạn chế. Theo Zhang et al. (2016), độ mặn làm thay đổi hệ vi sinh vật trong tôm, độ mặn càng cao thì Vibrio càng chiếm ưu thế, trong khi theo Vezzulli et al. (2013), nhiệt độ dưới 370C ảnh hưởng tiêu cực đến sự phát triển của Lactobacillus.
Cho nên, khám phá sinh học biển để phân lập vi khuẩn dùng làm chế phẩm sinh học trong nuôi thủy sản nước mặn – lợ là một giải pháp đầy hứa hẹn.

Men vi sinh phân lập từ bọt biển là một giải pháp đầy hứa hẹn cho nuôi trồng thủy sản.
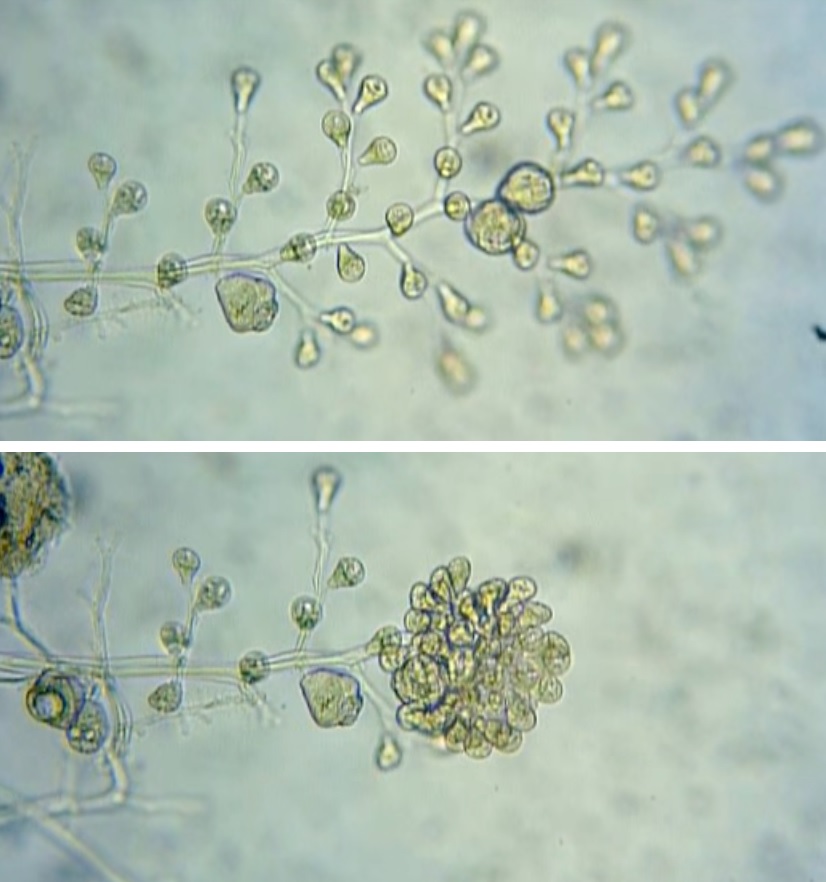
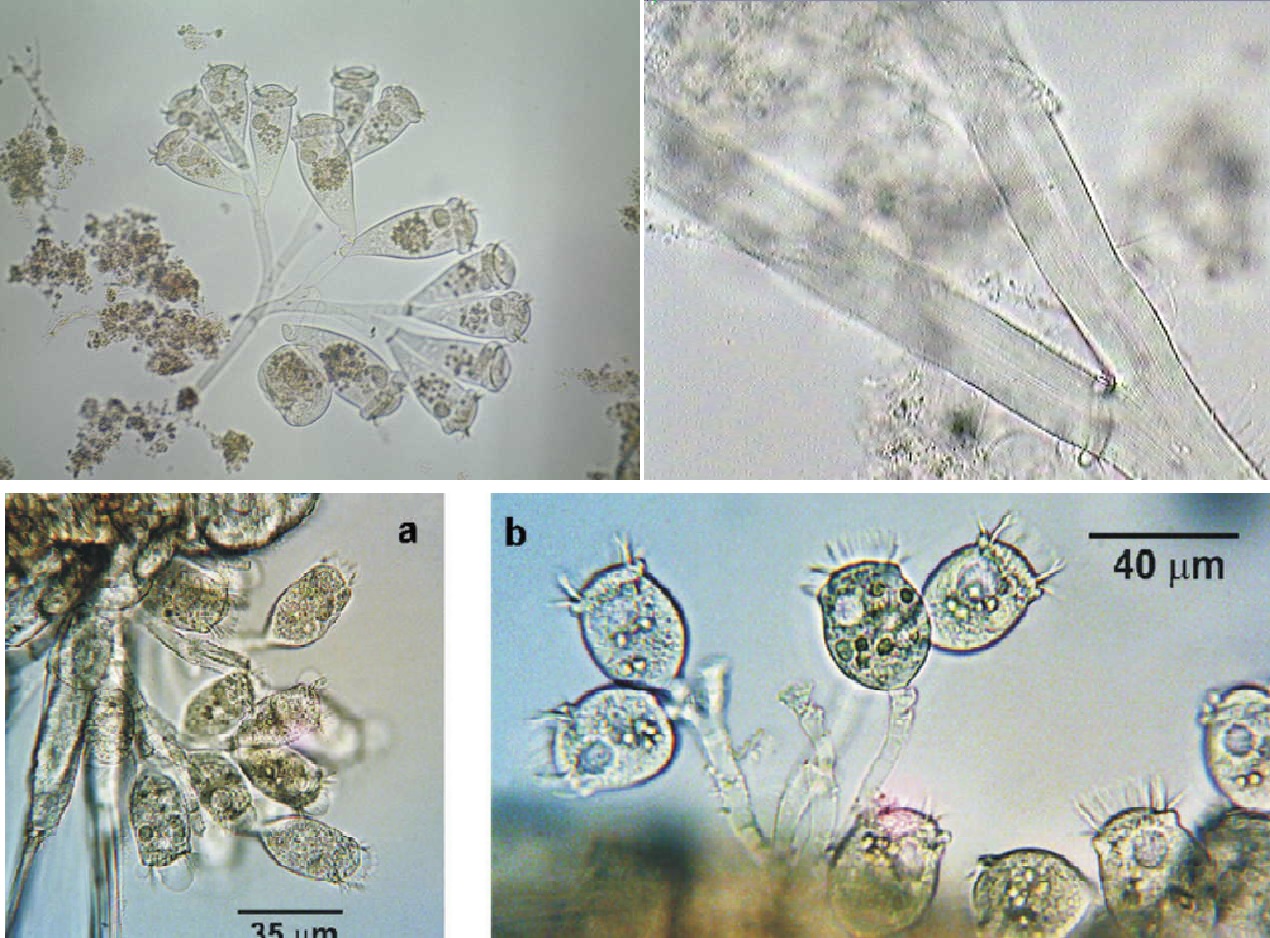
Pseudovibrio chiết xuất từ bọt biển
Động vật không xương sống dưới biển, đặc biệt là bọt biển, chứa các cộng đồng vi sinh vật rất đa dạng. Trong số các vi khuẩn biển có thể nuôi cấy thì nổi bật là chi Pseudovibrio nhờ tính linh hoạt có thể tạo ra hoạt tính sinh học chống lại đa dạng các vi khuẩn Gram âm và Gram dương như: E. coli, Bacillus subtilis, Kluyveromyces marxianus, Salmonella enterica, Staphylococcus aureus kháng methicillin (MRSA) và Clostridium difficile.
Thiết lập nghiên cứu
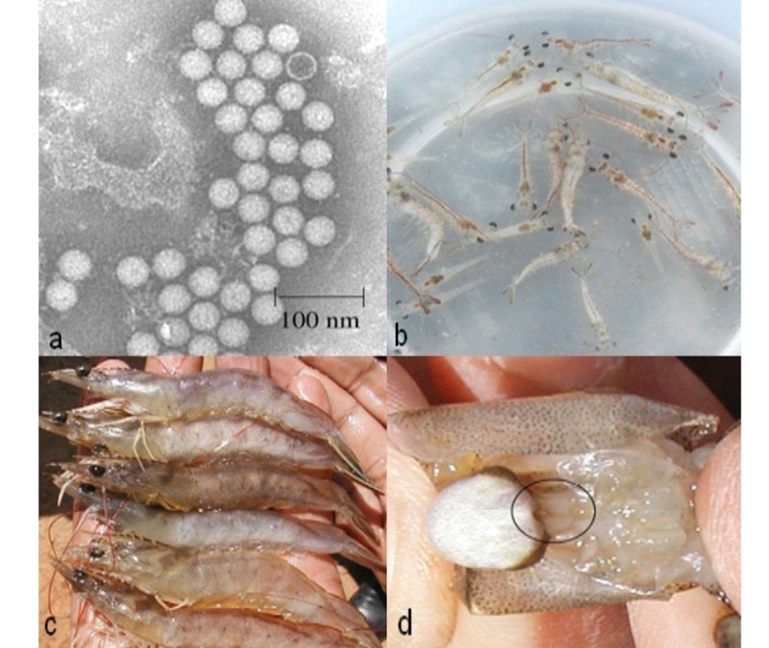
Tổng cộng có chín mẫu bọt biển A. geradogreeni đã thu thập trong bốn môi trường sống ở độ sâu khác nhau từ 10-30 m ở vùng nước ven biển của tỉnh Santa Elena (Ecuador). Phân loại của các phân lập biểu hiện hoạt tính sinh học xác định dựa trên trình tự nucleotide của gen 16 rRNA. Với việc nuôi cấy Pseudovibrio thuần túy, các dịch độc dược được thực hiện trong môi trường Luria-Bertani với NSW và 20% glycerol, được lưu trữ ở -800C cho các thử nghiệm tiếp theo.
Kết quả và thảo luận
Các nhà nghiên cứu đã phân tách một số chủng P.denitrificans, thử nghiệm thử thách trong phòng thí nghiệm và trong ao nuôi.

Hiệu quả có lợi của chủng Pseudovibrio đối với tôm thẻ chân trắng (thời gian theo dõi: 108 ngày).
Hoạt tính kháng khuẩn của các chủng Pseudovibrio liên quan với quá trình chuyển hóa acid sulfuric và acid tropodithietic có thể tiêu diệt hoặc ức chế mầm bệnh Vibrio spp. ở ấu trùng cá biển. Ngoài ra, nhiệt độ và độ mặn là ưu thế để Pseudovibrio cạnh tranh với Vibrio spp. Vì Pseudovibrio là một loại vi khuẩn điển hình trong môi trường biển, có mức tăng trưởng tối ưu khoảng từ 25-310C.
Các nhà nghiên cứu đã tìm thấy hoạt tính sinh học chống lại V. parahaemolyticus, V. campbellii, V. Vulnificus và V. harveyi và chống lại chủng gây bệnh có độc tính cao của V. parahaemolyticus BA94C2 dương tính với PirA/PirB, độc tố liên quan đến bệnh lý AHPND trong nuôi tôm. Ngoài ra, các xét nghiệm được tiến hành ở giai đoạn ấu trùng tôm Postlarvae 3 ngày đã bị nhiễm V. harveyi cho thấy khả năng cạnh tranh của của P. denitrificans với mầm bệnh, giúp cải thiện tỷ lệ sống của PL.

A) Tỷ lệ sống của PL tôm thẻ nhiễm V. campbellii sau 5 ngày điều trị với Pseudovibrio.
B) Tỷ lệ sống của PL tôm thẻ nhiễm V. parahaemolyticus sau 5 ngày điều trị với Pseudovibrio.
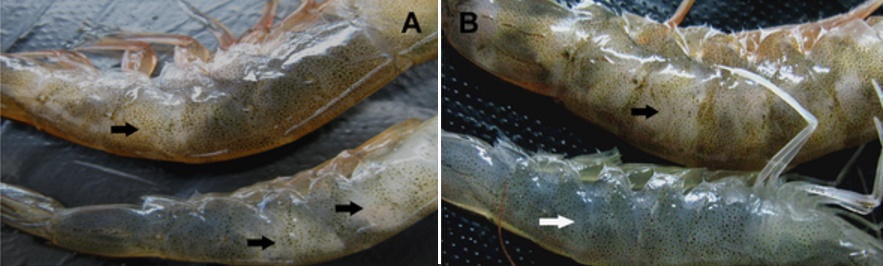
Tác dụng của P. denitrificans đối với bệnh phát sáng ở tôm giống do các chủng Vibrio gây ra đã được chứng minh thông qua thí nghiệm thực tế trong sản xuất giống. Ngoài ra, P. denitrificans còn giúp tăng sản lượng, tỷ lệ sống, trọng lượng và năng suất thu hoạch tôm bình quân ở nuôi tôm thương phẩm.

Hiệu quả của các chủng P. denitrificans xâm chiếm và thay thế các chủng Vibrio trong tôm 48 giờ sau khi sử dụng P. denitrificans
Hoạt tính sinh học của Pseudovibrio denitrificans qua các thí nghiệm invitro đã được khẳng định khả năng kháng khuẩn, ức chế mầm bệnh, nâng cao tỷ lệ sống của tôm cá nhiễm bệnh trong nuôi trồng thủy sản. Tuy nhiên, trong tương lai vẫn còn cần thực hiện nhiều nghiên cứu hơn để đánh giá nồng độ thực tế để áp dụng ở quy mô thương mại.
Theo CRISTÓBAL DOMÍNGUEZ-BORBOR và cộng sự.