Tiến bộ trong việc phát triển các chiến lược theo dõi quản lý đối với bệnh tôm lớn
Bệnh hoại tử gan cấp tính (AHPND), còn được gọi là hội chứng tử vong sớm (EMS), đã ảnh hưởng nghiêm trọng đến tôm nuôi ở một số quốc gia. Kết quả của nghiên cứu này sẽ hỗ trợ trong việc phát triển các chiến lược giám sát quản lý để hạn chế sự lây lan của bệnh và giảm tác động của nó đối với các trang trại nuôi tôm thương mại.
Nghiên cứu này đã phân tích trình tự plasmid từ toàn bộ trình tự bộ gen của AHPND V. parahaemolyticus ( Vp ) – một bệnh tôm nghiêm trọng – phân tách và xác định một biến thể địa lý rõ ràng trong phân tử plasmid và phát triển các phương pháp PCR để mô tả AHPND V.p phân tách được như là dạng Mexico hoặc Đông Nam Á. Việc tìm kiếm một biến thể trình tự địa lý trong plasmid độc lực AHPND có thể được sử dụng như một dấu hiệu để theo dõi sự lây lan của bệnh này.
Trong nghiên cứu này, chúng tôi đã phân tích các biến chuỗi trong độc lực lớn plasmid mang pirA- và pirB- như gen độc tố, trong số Vibrio parahaemolyticus chủng gây bệnh cấp tính hoại tử hepatopancreatic (AHPND). Chúng tôi đã tìm thấy một vùng biến (4.243-bp) tương ứng với các vị trí địa lý thu thập của các phân lập AHPND. Sau đó, chúng tôi đã phát triển và áp dụng một xét nghiệm PCR song công có thể phục vụ chẩn đoán AHPND và hơn nữa, để phân biệt giữa các chủng AHPND gây bệnh được thu thập từ các khu vực địa lý khác nhau.
Sự biến đổi trình tự của plasmid độc lực AHPND
Chúng tôi đã so sánh sự thay đổi trình tự trong plasmid độc lực (pVPA3-1) trong số chín chủng địa lý (toàn bộ trình tự bộ gen GenBank số được liệt kê trong Bảng 1). Các trình tự plasmid độc lực này đã được xác định và tập hợp từ toàn bộ trình tự bộ gen (WGS) của AHPND- V. parahaemolyticus bằng các phân tích vụ nổ. Ở Mexico, các chủng AHPND- V. parahaemolyticus (M0605 và FIM-S1708 +), transposeon giống Tn3 là một mảnh 4243 bp được chèn vào ORF4 của pVPA3-1. Tuy nhiên, đoạn này không được tìm thấy trong 7 chủng AHPND được thu thập từ Đông Nam Á bao gồm Việt Nam, Trung Quốc và Thái Lan.
Gen transposon -Tn3 ở AHPND phân lập Mexico
Để xác định xem transposon -Tn3 chỉ được tìm thấy trong các chủng AHPND- V. parahaemolyticus được thu thập ở Mexico, chúng tôi đã chọn một cặp mồi PCR MX-345F (5′-TACCAGCTCTAACAAGGCCA) và MX-345R (5′-AACRAG khuếch đại DNA từ các phân lập AHPND trong các bộ sưu tập của chúng tôi (Bảng 1). Đoạn mồi phía trước nằm ở thượng nguồn của transposon – Tn3 và đoạn mồi ngược nằm trong transposon – Tn3 (Hình 1). Sự khuếch đại được thực hiện với các tham số sau: biến tính khởi đầu ở 94 o C trong 3 phút, sau đó là 35 chu kỳ 94 o C trong 30 giây, 60 o C trong 30 giây và 72 o C trong 30 giây và mở rộng cuối cùng ở 72 oC trong 7 phút. Chúng tôi đã áp dụng phương pháp PCR này ở 29 mẫu nuôi cấy AHPND- V. parahaemolyticus thuần chủng và kết quả cho thấy tất cả 12 chủng phân lập ở Mexico đều dương tính với sự hiện diện của transposon – Tn3 và không cái nào trong số 13 chủng AHPND Việt Nam dương tính với Tn3-transposon
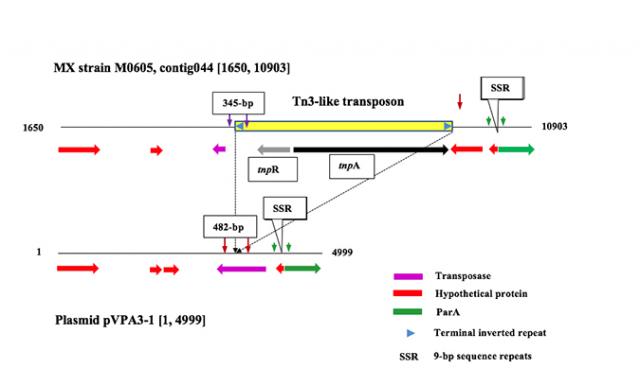 Hình 1. Biểu đồ của một transposon -Tn3 trong bệnh hoại tử gan cấp tính (AHPND) plasmid độc lực. Các con số ở hai đầu chỉ ra vị trí nucleotide trong contig044 của chủng M0605 ở Mexico và plasmid pVPA3-1 chứa trong chủng Việt Nam 13-028 / A3.
Hình 1. Biểu đồ của một transposon -Tn3 trong bệnh hoại tử gan cấp tính (AHPND) plasmid độc lực. Các con số ở hai đầu chỉ ra vị trí nucleotide trong contig044 của chủng M0605 ở Mexico và plasmid pVPA3-1 chứa trong chủng Việt Nam 13-028 / A3.
PCR loại AHPND châu Á
Một cặp mồi PCR khác Asia-482F (5′-TGAACCGTTCCTCATGCTCT) và Asia-482R (5′-TCAAAGCAGCCCAGACAAAC) được chọn bên ngoài transposon -Tn3, trong ORF4 của pVPA3 kích thước khuếch đại dự kiến là 482-bp đối với các chủng phân lập từ Đông Nam Á (Hình 1). Kết quả cho thấy tất cả 13 mẫu nuôi cấy AHPND thuần chủng từ Việt Nam đều dương tính và không có 13 mẫu phân lập Mexico nào dương tính. Những mồi này cũng có thể ủ cho các phân lập Mexico, nhưng kích thước của các bộ khuếch đại sẽ là 4732-bp, các sản phẩm PCR không được phát hiện với hồ sơ chu kỳ PCR được sử dụng.
PCR kép để chẩn đoán và loại AHPND
Để phát hiện đồng thời AHPND và loại plasmid, 2 cặp mồi – MX-345F / R (hoặc Châu Á-382F / R) và VpPirA-284F (5′-TGACTATTCTCACGATTGGACTG) / VpPirA-284R (5’C) một ống đơn trong quá trình PCR. Sự khuếch đại đã được thực hiện với hồ sơ xoay vòng được mô tả ở trên. Tất cả các thử nghiệm nuôi cấy vi khuẩn cho thấy các dải ở 284-bp cho thấy sự hiện diện của gen độc tố, như mong đợi. Nuôi cấy vi khuẩn phân lập từ Mexico cũng cho thấy một dải ở 345-bp, cho thấy sự hiện diện của transposon -Tn3. Ngược lại, các phân lập AHPND của Việt Nam cho thấy một dải ở 482-bp, cho thấy sự vắng mặt của transposon -Tn3 (Hình 2).
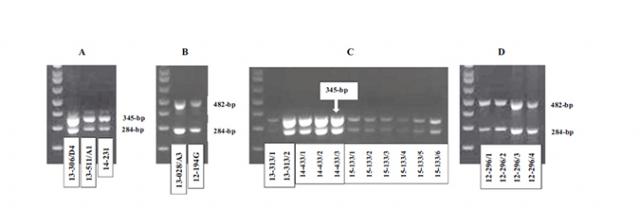 Hình 2. Phát hiện PCR kép và các chủng hoại tử gan tụy cấp tính (AHPND) của các chủng V. parahaemolyticus trong các mẫu được thu thập ở Mexico và Việt Nam trong giai đoạn 2012 đến 2015. Nuôi cấy vi khuẩn thuần chủng được phân lập từ tôm bị nhiễm bệnh ở Mexico (A) và Việt Nam (B) ); DNA chiết xuất từ mô gan tụy của tôm bị nhiễm bệnh được thu thập ở Mỹ Latinh (C) và Việt Nam (D).
Hình 2. Phát hiện PCR kép và các chủng hoại tử gan tụy cấp tính (AHPND) của các chủng V. parahaemolyticus trong các mẫu được thu thập ở Mexico và Việt Nam trong giai đoạn 2012 đến 2015. Nuôi cấy vi khuẩn thuần chủng được phân lập từ tôm bị nhiễm bệnh ở Mexico (A) và Việt Nam (B) ); DNA chiết xuất từ mô gan tụy của tôm bị nhiễm bệnh được thu thập ở Mỹ Latinh (C) và Việt Nam (D).
Để kiểm tra điều này, chúng tôi đã áp dụng phương pháp song công cho 15 mẫu DNA được chiết xuất từ các mô gan tụy của tôm bị ảnh hưởng AHPND. Mười một con tôm được thu thập từ các trang trại ở các nước Mỹ Latinh và bốn con được thu thập từ các trang trại ở Việt Nam. Đối với các mẫu của Mỹ Latinh, PCR hai mặt cho thấy các dải ở 345-bp và 284-bp (Hình 2), cho thấy những con tôm này đã bị nhiễm vi khuẩn gây bệnh AHPND, như được hiển thị bởi dải 284 bp, và những vi khuẩn này có chứa Tn3 – transposeon. Đối với 4 mẫu được thu thập từ Việt Nam, PCR song công cho kết quả là các dải 482-bp và 284-bp (Hình 2), cho thấy nhiễm vi khuẩn AHPND không có transposon -Tn3. Do đó, phương pháp song công được mô tả ở đây rất hữu ích trong chẩn đoán và đánh máy vi khuẩn AHPND của tôm bị nhiễm bệnh thu thập từ ao.
So sánh độc lực giữa phân lập Mexico và Việt Nam
Mặc dù nó được tìm thấy trên plasmid độc lực của V . parahaemolyticus, transposon -T3 dường như không liên quan đến mức độ độc lực. Chúng tôi đã làm nhiễm khuẩn tôm thẻ chân trắng với cả các chủng phân lập ở Mexico (13-511 / A1) và Việt Nam (13-028 / A3) trong các xét nghiệm sinh học. Bể cá (3-L) chứa đầy nước biển nhân tạo ở độ mặn 25 ppt và nhiệt độ nước được duy trì ở 28 ° C. Sau đó, tôm thẻ chân trắng không chứa mầm bệnh (SPF) (trọng lượng trung bình: 1g) được thả trong bể và được cho ăn bằng V. parahaemolyticus 13-028 / A3 và 13-511 / A1, trộn với thức ăn của tôm. Vi khuẩn được tăng lên 1 × 10 9CFU / mL và trộn với thức ăn cho tôm theo tỷ lệ 1: 1. Tỷ lệ tử vong tích lũy 100 phần trăm đã được nhìn thấy ở cả hai chủng phân lập vào ngày thứ 3 (Hình 3).
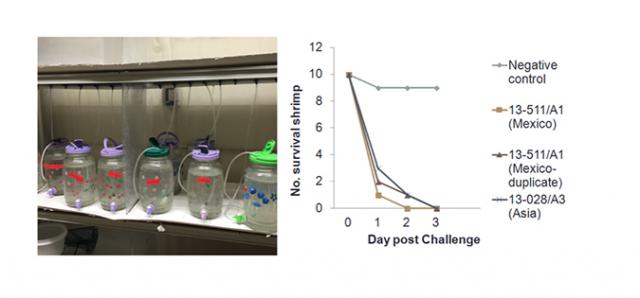 Hình 3. So sánh độc lực. Tôm ( P. vannamei ) bị nhiễm phân lập AHPND Mexico (13-511 / A1) và phân lập AHPND Việt Nam (13-028 / A3) trong các xét nghiệm sinh học. Tất cả tôm đã trở nên hấp hối hoặc chết trong vòng 3 ngày và không có sự khác biệt đáng kể về độc lực AHPND giữa các chủng phân lập ở Mexico và châu Á.
Hình 3. So sánh độc lực. Tôm ( P. vannamei ) bị nhiễm phân lập AHPND Mexico (13-511 / A1) và phân lập AHPND Việt Nam (13-028 / A3) trong các xét nghiệm sinh học. Tất cả tôm đã trở nên hấp hối hoặc chết trong vòng 3 ngày và không có sự khác biệt đáng kể về độc lực AHPND giữa các chủng phân lập ở Mexico và châu Á.
Mặc dù chức năng của biến thể di truyền giữa các chủng địa lý của V . parahaemolyticus vẫn chưa được biết, sự biến đổi trình tự như sự hiện diện hay vắng mặt của một transposon có thể đóng vai trò là các dấu hiệu hữu ích để phát hiện nguồn gốc của các vụ dịch mới. Có sự khác biệt lớn là sự hiện diện của một transposon -Tn3 ở Mexico và các khu vực châu Mỹ Latinh không có ở các phân lập châu Á. Nó cho thấy rằng các phân lập Mexico và Mỹ Latinh có chung nguồn gốc. Ngoài ra, điều này sẽ hỗ trợ trong việc phát triển các chiến lược giám sát quản lý để hạn chế sự lây lan của bệnh và giảm tác động của nó đối với các trang trại nuôi tôm thương mại.










 >> Ông Boonlap Watcharawanitchakul, Phó Tổng Giám đốc cấp cao C.P. Việt Nam cho biết: “Năm 2020, trong chiến lược của C.P. Việt Nam sẽ tiếp tục tập trung vào việc chuyển giao và nhân rộng mô hình nuôi tôm công nghệ cao CPF-Combine, đặc biệt là mô hình CPF-Combine phiên bản 2. Để hỗ trợ cho các khách hàng vận hành thành công mô hình, C.P. Việt Nam sẽ chú trọng đào tạo, bồi dưỡng nguồn nhân lực, tăng cường thêm các cán bộ kỹ thuật có chuyên môn giỏi tại mỗi vùng nuôi tôm, đội ngũ nhân viên này sẽ luôn kề vai sát cánh cùng với khách hàng”.
>> Ông Boonlap Watcharawanitchakul, Phó Tổng Giám đốc cấp cao C.P. Việt Nam cho biết: “Năm 2020, trong chiến lược của C.P. Việt Nam sẽ tiếp tục tập trung vào việc chuyển giao và nhân rộng mô hình nuôi tôm công nghệ cao CPF-Combine, đặc biệt là mô hình CPF-Combine phiên bản 2. Để hỗ trợ cho các khách hàng vận hành thành công mô hình, C.P. Việt Nam sẽ chú trọng đào tạo, bồi dưỡng nguồn nhân lực, tăng cường thêm các cán bộ kỹ thuật có chuyên môn giỏi tại mỗi vùng nuôi tôm, đội ngũ nhân viên này sẽ luôn kề vai sát cánh cùng với khách hàng”. 












